ข้อสังเกตที่ได้จากการใช้จัดเรียงอิเล็กตรอนในอะตอม
1. เลขอะตอมคู่จะอยู่ในหมู่คู่ เลขอะตอมคี่จะเป็นธาตุในหมู่คี่ เช่น
ธาตุ 14 Si จะเป็นธาตุในหมู่ 4
ธาตุ 11 Na จะเป็นธาตุในหมู่ 1
2. ธาตุหมู่ IA และ IIA ตั้งแต่คาบ 3 ขึ้นไป จะมีจำนวนอิเล็กตรอนในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ชั้นเป็น 8 เสมอ เช่น
11 Na จะจัดเรียงอิเล็กตรอนเป็น 2, 8, 1 12 Mg จะจัดเรียงอิเล็กตรอนเป็น 2, 8, 2
19 K จะจัดเรียงอิเล็กตรอนเป็น 2, 8, 8, 1 20 Ca จะจัดเรียงอิเล็กตรอนเป็น 2, 8, 8, 2
3. ธาตุหมู่ IIIA ถึง VIIIA ตั้งแต่หมู่ที่ IIIA คาบ 4 เป็นต้นไป จะมีจำนวนอิเล็กตรอนในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ชั้นเป็น 18 เสมอ เช่น
31 Ga 2, 8, 18, 3 (หมู่ 3 คาบ 4)
33 As 2, 8, 18, 5 (หมู่ 5 คาบ 4)
4. ถ้าธาตุนั้นมีการจัดเรียงอิเล็กตรอนไม่เป็นไปตามข้อ 2 และ 3 คือมีจำนวนอิเล็กตรอนในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ชั้น มีค่าตั้งแต่ 9 – 18 แต่วงนอกสุดมีเวเลนซ์อิเล็กตรอนเป็น 1หรือ 2 นักเรียนก็ทำนายได้ทันทีว่าเป็นธาตุแทรนซิชัน เช่น
29 Cu 2, 8, 18, 1 ไม่ใช่เป็นธาตุหมู่ 1 แต่เป็นธาตุแทรนซิชันจัดเรียงอิเล็กตรอนเป็น 2, 8,18, 1
23 V 2, 8, 8, 5 ไม่ใช่เป็นธาตุหมู่ 1 แต่เป็นธาตุแทรนซิชันจัดเรียงอิเล็กตรอนเป็น 2, 8,11, 2
หมายเหตุ ธาตุแทรนซิชันที่มีเลขอะตอมตั้งแต่ 21 – 30 จะมีเวเลนซ์อิเล็กตรอนเป็น 2 ยกเว้น Cu กับ Cr จะมีเวเลนซ์อิเล็กตรอนเป็น 1
ตารางธาตุ ก่อนจะเป็นตารางธาตุ
ปี พ.ศ. 2360 โยฮันน์ เดอเบอไรเนอร์ ชุดสาม
หลักการนี้ใช้ไม่ได้กับธาตุบางชนิด ชุดสามของกลุ่มธาตุบางชนิด ธาตุตรงกลาง มีมวลอะตอมไม่เท่ากับค่าเฉลี่ยของธาตุที่เหลือทั้ง 2
ปี พ.ศ. 2407 จอห์น นิว แลนด์ ถ้าเรียงธาตุตามมวลอะตอมจากน้อยไปหามากพบว่าธาตุที่ 8 จะมีสมบัติเหมือนกับธาตุที่ 1 เสมอ
ธาตุที่ 8 จะมีสมบัติเหมือนกับธาตุที่ 1 เสมอ
ปี พ.ศ. 2412 ยูลิ อุสโลทาร์ ไม เออร์ ดิมิท รี อิ วา – โน วิช เมน เดเลเอฟ เรียงตามมวลอะตอมจากน้อยไปมาก กฏพิ ริออดิก ตารางพิ ริออดิกของเมน เดเลเอฟ
ตารางธาตุของเมนเดเลเอฟ
ต่อมา เฮนรี โมสลีย์ ตารางธาตุปัจจุบันจึงจัดเรียงตามเลขอะตอมจากน้อยไปมาก
ตารางธาตุปัจจุบัน เรียงตามเลขออะตอมจากน้อยไปมาก
สรุปเกี่ยวกับตารางธาตุ แบ่งธาตุในแนวตั้ง (หมู่) แบ่งออกเป็น 18 แถว โดยธาตุทั้งหมด 18 แถว แบ่งเป็น 2 กลุ่มใหญ่ คือ
– กลุ่ม A มี 8 หมู่ คือ IA ถึง VIIIA
– กลุ่ม B มี 8 หมู่ คือ IB ถึง VIIIB เรียกว่า ธาตุแทรนซิชัน (Transition)
โดย
ธาตุหมู่ที่ IA เรียกว่า “โลหะ แอลคาไลน์ ” ได้แก่ Li Na K Rb Cs และ Fr ธาตุหมู่ที่ IIA เรียกว่า “ โลหะอัลคาไลน์ เอิร์ท ” ได้แก่ Be Mg Ca Sr Ba และ Ra ธาตุหมู่ที่ VIIA เรียกว่า “ธาตุเฮโลเจน (Halogen)” ได้แก่ F , Cl , Br , I และ At ธาตุหมู่ที่ VIIIA เรียกว่า “ก๊าซเฉื่อย (Inert gas or Noble gas) ” ได้แก่ He , Ne , Ar , Kr , Xe และ Rn
ตารางธาตุในแนวนอนเรียกว่า “คาบ ” แบ่งได้ 7 คาบ
คาบที่ 6 แบ่งธาตุเป็น 2 กลุ่ม
– กลุ่มแรกมี 18 ธาตุ คือ Cs ถึง Rn
– กลุ่มที่สองมี 14 ธาตุ คือ Ce ถึง Lu เรียกกลุ่มนี้ว่าLantanides
คาบที่ 7 แบ่งเป็น 2 กลุ่ม
– กลุ่มแรกเริ่มจาก Fr เป็นต้นไปและมีการค้นพบเกิดขึ้นตลอดเวลา
– กลุ่มสองมี 14 ธาตุคือ Th ถึง Lr เรียงกลุ่มนี้ว่า Actinides
“หมู่เดียวกัน จำนวนเวเลนซ์อิเล็กตรอนเท่ากัน เลขประจำหมู่”
“คาบเดียวกัน จำนวนระดับพลังงานเท่ากัน เลขที่คาบ”
กลุ่ม s, p, d และ f-block สามารถจัดกลุ่มได้ดังรูป
ธาตุในกลุ่ม s, p, d, และ f-block
การตั้งชื่อธาตุที่ค้นพบใหม่ ตั้งตามระบบ IUPAC ( International Union of Pure and Applied Chemistry )
ใช้กับธาตุที่มีเลขอะตอมตั้งแต่ 100 ขึ้นไป ให้ตั้งชื่อธาตุโดยระบุเลขอะตอมเป็น ภาษา ละ ติน – ium
ระบบการนับเลขในภาษาละ ติน
0 นิล ( nil )
1 อูน ( un )
2 ไบ ( bi )
3 ไตร ( tri ) 4 คว อด ( quad ) 5 เพนท์ ( pent ) 6 เฮกซ์ ( hex ) 7 เซปท์ ( s ept ) 8 ออกต์ ( oct ) 9 เอนน์ ( enn ) ตัวอย่างการเรียกชื่อ
ธาตุที่ 104 ตามระบบ IUPAC อ่านว่า
Unn+nil+quad+ium = Unnilquadium
Unn+nil+pent+ium = Unnilpentium
ส่วนที่ 2 สมบัติของธาตุตามหมู่และตามคาบ
1. ขนาดอะตอม
การบอกขนาดอะตอมจะบอกโดยใช้รัศมีอะตอม ซึ่งมีค่าเท่ากับครึ่งหนึ่งของระยะระหว่างนิวเคลียสของอะตอมทั้งสองที่มีแรงยึดเหนี่ยวอะตอมไว้ด้วยกันหรือที่อยู่ชิดกัน รัศมีอะตอมมีหลายแบบ ขึ้นอยู่กับชนิดของแรงที่ยึดเหนี่ยวระหว่างอะตอม
– รัศมีโคเวเลนต์ คือ ระยะทางครึ่งหนึ่งของความยาวพันธะโคเวเลนต์ระหว่างอะตอมชนิดเดียวกัน
– รัศมีแวนเดอร์วาลล์ คือระยะทางครึ่งหนึ่งของระยะระหว่างนิวเคลียสของอะตอมที่อยู่ใกล้ที่สุด
– รัศมีโลหะ คือ ระยะทางครึ่งหนึ่งของระยะระหว่างนิวเคลียสของอะตอมโลหะที่อยู่ใกล้กันมากที่สุด
ตัวอย่างรัศมีโลหะ
แนวโน้มขนาดอะตอมในตารางธาตุ
2. รัศมีไอออน
ไอออน
การบอกขนาดไอออนทำได้เช่นเดียวกับการบอกขนาดอะตอม ซึ่งพิจารณาจากระยะห่างระหว่างนิวเคลียสของไอออนคู่หนึ่งๆ ที่มีแรงยึดเหนี่ยวซึ่งกันและกันในโครงผลึก
ตัวอย่างรัศมีไอออน
แนวโน้มของขนาดไอออนในตารางธาตุ
3. พลังงาน ไออน ไนเซชัน ( Ionization Energy; IE)
คือ พลังงานจำนวนน้อยที่สุดที่ใช้ดึงอิเล็กตรอนออกจากอะตอมของธาตุที่เป็นแก๊สครั้งละ 1 อิเล็กตรอนทำให้กลายเป็นไอออนบวกที่เป็นแก๊ส
สามารถเขียนสมการได้ดังนี้
X ( g ) + IE —- > X + ( g ) + e –
ตัวอย่าง ค่า IE1 ถึง IE3 ของ Li
Li(g) + (g) + e– IE1 = 520 kJ/mol
Li+ (g) 2+ (g) + e– IE2 = 7,394 kJ/mol
Li2+ (g) 3+ (g) + e– IE3 = 11,815 kJ/mol
ตัวอย่างกราฟไอออนไนเซชัน
แนวโน้มค่า IE
4. อิเล็กโตรเน กาติวิตี ( Electronegativity; EN)
คือ ค่าที่แสดงความสามารถในการดึงอิเล็กตรอนเข้าหาตัวเองของอะตอมของธาตุ ในพันธะเคมีหนึ่ง อะตอมที่มีค่า EN สูงจะดึงดูดอิเล็กตรอนได้ดีกว่าอะตอมที่มี EN ต่ำ
แนวโน้มค่า EN ในตารางธาตุ
ลักษณะทั่วไป
โลหะทั่วไปมีค่า EN ต่ำกว่า จึงเสียอิเล็กตรอนได้ง่ายกว่าเกิดไอออนบวก อโลหะทั่วไปมีค่า EN สูง จึงชิงอิเล็กตรอนได้ดีเกิดไอออนลบ ธาตุเฉื่อยไม่มีค่า EN ค่า EN ขึ้นอยู่กับ
ก. ขนาดอะตอม หรือจำนวนระดับพลังงาน
ข. ถ้าอะตอมที่มีจำนวนระดับพลังงานเท่ากัน ค่า EN ขึ้นอยู่กับจำนวนโปรตอนในนิวเคลียสเป็นเกณฑ์
5. สัม พรรคภาพอิเล็กตรอน ( Electron Affinity; EA)
สัม พรรคภาพอิเล็กตรอน พลังงาน คายออกมา รับ อิเล็กตรอน
แนวโน้มค่า EA
6. จุดเดือดและจุดหลอมเหลว
แนวโน้มจุดเดือดและจุดหลอมเหลว ตามหมู่
หมู่ IA IIA และ IIIA ลดลงจากบนลงล่าง (ลดตามเลขอะตอมที่เพิ่มขึ้น) หมู่ VA VIA VIIA และ VIIIA เพิ่มขึ้นจากบนลงล่าง (เพิ่มตามเลขอะตอม) หมู่ IVA มีแนวโน้มที่ไม่แน่นอน
ตามคาบ
หมู่ IA IIA IIIA และ IVA แนวโน้มสูงขึ้น หมู่ IVA มีจุดเดือดและจุดหลอมเหลวสูงที่สุด เพราะบางธาตุมีโครงสร้างเป็นผลึกร่างตาข่าย หมู่ VA VIA VIIA และ VIIIA จุดเดือด จุดหลอมเหลวต่ำ เนื่องจากมีแรงยึดเหนี่ยวระหว่างโมเลกุลที่มีค่าต่ำมาก
7. เลขออกซิเดชัน ( Oxidation Number)
เลขออกซิเดชัน
ธาตุแต่ละชนิดมีเลขออกซิเดชันเป็นเท่าไหร่ให้เป็นไปตามเกณฑ์ดังนี้
ธาตุแทรนซิชัน
3.4.1 สมบัติของธาตุแทรนซิชัน ตาราง 3.5 สมบัติบางประการของโพแทสเซียม แคลเซียม และธาตุแทรนซิชันในคาบที่ 4
ตาราง 3.6 การจัดเรียงอิเล็กตรอนของธาตุโพแทสเซียม แคลเซียม และธาตุแทรนซิชันในคาบที่ 4
3.4.2 สารประกอบของธาตุแทรนซิชัน
[ tex]Cr^ +[/tex] อะตอมจะเสีย 1 อิเล็กตรอนในระดับพลังงานนอกสุดก่อนคือ 4s เมื่อเกิดเป็นไอออนที่มีประจุสูงขึ้น อะตอมจะเสียอิเล็กตรอนเพิ่มขึ้นซึ่งเป็นอิเล็กตรอนที่อยู่ในระดับพลังงาน 3d การที่โครเมียมสามารถให้อิเล็กตรอนในระดับพลังงานที่ถัดเข้าไปจากระดับพลังงานนอกสุดและเกิดเป็นไอออนที่เสถียร ทำให้โครเมียมมีเลขออกซิเดชันได้หลายค่า ธาตุแทรนซิซันอื่นๆ ก็สามารถให้อิเล็กตรอนในลักษณะเดียวกับโครเมียมและมีเลขออกซิเดชันได้หลายค่าจึงเกิดสารประกอบได้หลายชนิดซึ่งนักเรียนได้ศึกษาเลขออกซิเดชันของธาตุในสารประกอบของธาตุเหล่านี้มาแล้ว3.4.3 สารประกอบเชิงซ้อนของธาตุแทรนซิชัน
การทดลอง การเตรียมสารประกอบเชิงซ้อนของทองแดง
ธาตุกัมมันตรังสี (radioactive element)
คือธาตุพลังงานสูงกลุ่มหนึ่งที่สามารถแผ่รังสี แล้วกลายเป็นอะตอมของธาตุใหม่ได้ มีประวัติการค้นพบดังนี้
รังสีเอ็กซ์ ถูกค้นพบโดย Conrad Röntgen อย่างบังเอิญเมื่อปี ค.ศ. 1895 ยูเรเนียม ค้นพบโดย Becquerel เมื่อปี ค.ศ. 1896 โดยเมื่อเก็บยูเรเนียมไว้กับฟิล์มถ่ายรูป ในที่มิดชิด ฟิล์มจะมีลักษณะ เหมือนถูกแสง จึงสรุปได้ว่าน่าจะมีการแผ่รังสีออกมาจากธาตุยูเรเนียม เขาจึงตั้งชื่อว่า Becquerel Radiation พอโลเนียม ถูกค้นพบและตั้งชื่อโดย มารี กูรี ตามชื่อบ้านเกิด (โปแลนด์) เมื่อปี ค.ศ. 1898 หลังจากการสกัดเอายูเรเนียมออกจาก Pitchblende หมดแล้ว แต่ยังมีการแผ่รังสีอยู่ สรุปได้ว่ามีธาตุอื่นที่แผ่รังสีได้อีกแฝงอยู่ใน Pitchblende นอกจากนี้ กูรียังได้ตั้งชื่อเรียกธาตุที่แผ่รังสีได้ว่า ธาตุกัมมันตรังสี และเรียกรังสีนี้ว่า กัมมันตภาพรังสี เรเดียม ถูกตั้งชื่อไว้เมื่อปี ค.ศ. 1898 หลังจากสกัดเอาพอโลเนียมออกจากพิตช์เบลนด์หมดแล้ว พบว่ายังคงมีการแผ่รังสี จึงสรุปว่ามีธาตุอื่นที่แผ่รังสีได้อีกใน Pitchblende ในที่สุดกูรีก็สามารถสกัดเรเดียมออกมาได้จริง ๆ จำนวน 0.1 กรัม ในปี ค.ศ. 1902
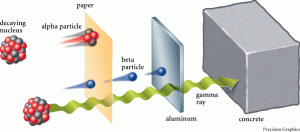
ส่วนรังสีที่แผ่ออกมาจากธาตุนั้น แบ่งเป็น 3 ชนิดคือ
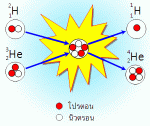
รังสีแอลฟา (สัญลักษณ์: α) คุณสมบัติ เป็นนิวเคลียสของอะตอมฮีเลียม (4 2He) มี p+ และ n อย่างละ 2 อนุภาค ประจุ +2 เลขมวล 4 อำนาจทะลุทะลวงต่ำ เบี่ยงเบนในสนามไฟฟ้าเข้าหาขั้วลบ รังสีบีตา (สัญลักษณ์: β) คุณสมบัติ เหมือน e- อำนาจทะลุทะลวงสูงกว่า α 100 เท่า ความเร็วใกล้เสียง เบี่ยงเบนในสนามไฟฟ้าเข้าหาขั้วบวก รังสีแกมมา (สัญลักษณ์: γ) คุณสมบัติเป็นคลื่นแม่เหล็กไฟฟ้า (Electromagnetic Wave) ที่มีความยาวคลื่นสั้นมากไม่มีประจุและไม่มีมวล อำนาจทะลุทะลวงสูงมาก ไม่เบี่ยงเบนในสนามไฟฟ้า เกิดจากการที่ธาตุแผ่รังสีแอลฟาและแกมมาแล้วยังไม่เสถียร มีพลังงานสูง จึงแผ่เป็นคลื่นแม่เหล็กไฟฟ้าเพื่อลดระดับพลังงาน จะเห็นได้ว่า การแผ่รังสีจะทำให้เกิดธาตุใหม่ได้ หรืออาจเป็นธาตุเดิมแต่จำนวนโปรตอนหรือนิวตรอนอาจไม่เท่ากับธาตุเดิมและธาตุกัมมันตรังสีแต่ละธาตุ มีระยะเวลาในการสลายตัวแตกต่างกันและแผ่รังสีได้แตกต่างกันเรียกว่า ครึ่งชีวิตของธาตุ
ครึ่งชีวิตของธาตุ (Half life)
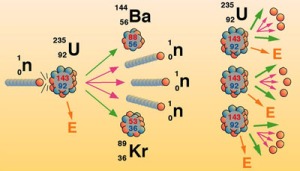
การเกิดปฏิกิริยาของธาตุกัมมันตรังสี การเกิดปฏิกิริยาของธาตุกัมมันตรังสี เรียกว่า ปฏิกิริยานิวเคลียร์ ซึ่งมี 2 ประเภท คือ 1. ปฏิกิริยาฟิชชัน (Fission reaction) คือ ปฏิกิริยานิวเคลียร์ที่เกิดขึ้น เนื่องจากการยิงอนุภาคนิวตรอนเข้าไปยังนิวเคลียสของธาตุหนัก แล้วทำให้นิวเคลียร์แตกออกเป็นนิวเคลียร์ที่เล็กลงสองส่วนกับให้อนุภาคนิวตรอน 2-3 อนุภาค และคายพลังงานมหาศาลออกมา ถ้าไม่สามารถควบคุมปฏิกิริยาได้อาจเกิดการระเบิดอย่างรุนแรงที่เรียกว่า ลูกระเบิดปรมาณู (Atomic bomb) เพื่อควบคุมปฏิกิริยาลูกโซ่ไม่ให้เกิดรุนแรงนักวิทยาศาสตร์จึงได้สร้างเตาปฏิกรณ์ปรมาณูเพื่อใช้ในการผลิตกระแสไฟฟ้า
ประโยชน์ของธาตุกัมมันตรังสี ความสามารถในการปลดปล่อยพลังงาน และรังสีที่มีพลังงานและมีอำนาจทะลุทะลวงของธาตุกัมมันตรังสีได้ถูกนำไปประยุกต์ใช้ให้เกิดประโยชน์ในด้านต่าง ๆ มากมายทั้งในด้านการแพทย์ การเกษตร อุตสาหกรรม รวมจนถึงด้านธรณีวิทยาการหาอายุของวัตถุต่าง ๆ โดยธาตุกัมมันตรังสีที่มีการใช้ประโยชน์กันอย่างกว้างขวาง ได้แก่
1 ยูเรเนียม-235 (U-235) ใช้สำหรับเป็นเชื้อเพลิงในโรงไฟฟ้าพลังนิวเคลียร์ ใช้ในอุตสาหกรรมการผลิตเครื่องบินและยานอวกาศ และใช้ในการผลิตรังสีเอ็กซ์ (X-ray) ซึ่งมีพลังงานสูง
2 โคบอลต์-60 (Co-60) เป็นธาตุกัมมันตรังสีที่สามารถแผ่กัมมันตรังสีชนิดแกมมาซึ่งมีผลในการยับยั้งการเจริญเติบโตของเซลล์ได้ จึงมีการนำมาใช้ในการยับยั้งการเจริญเติบโตเชื้อจุลินทรีย์ในอาหาร ผักและผลไม้ และนำมาใช้ในการรักษาโรคมะเร็ง
3 คาร์บอน-14 (C-14) เป็นธาตุกัมมันตรังสีที่สามารถพบได้ในวัตถุต่าง ๆ เกือบทุกชนิดบนโลก จึงสามารถนำระยะเวลาครึ่งชีวิตของธาตุนี้มาใช้ในการคำนวณหาอายุของวัตถุโบราณ อายุของหินและเปลือกโลกและอายุของซากฟอสซิลต่าง ๆ ได้ (C-14 มีครึ่งชีวิตประมาณ 5,730 ปี
4 ฟอสฟอรัส-32 (P-32) เป็นสารประกอบกัมมันตรังสีที่สามารถละลายน้ำได้ มีระยะเวลาครึ่งชีวิตประมาณ 14.3 วัน ทางการแพทย์นำมาใช้ในการรักษาโรคมะเร็งของเม็ดโลหิตขาว (ลิวคีเมีย) โดยให้รับประทานหรือฉีดเข้าในกระแสโลหิต นอกจากนี้ยังสามารถใช้ในการตรวจหาเซลล์มะเร็ง และตรวจหาปริมาณโลหิตของผู้ที่จะเข้ารับการผ่าตัด
อันตรายจากธาตุกัมมันตรังสี อันตรายจากธาตุกัมมันตรังสีเกิดขึ้นได้ เนื่องจากหากร่างกายของสิ่งมีชีวิตได้รับกัมมันตรังสีในปริมาณที่มากเกินไปจะทำให้โมเลกุลของน้ำ สารอินทรีย์และสารอนินทรีย์ต่าง ๆ ในร่างกายเสียสมดุล ทำให้เกิดความเสียหายต่อเซลล์ในร่างกาย ซึ่งจะทำให้สิ่งมีชีวิตเกิดความเจ็บป่วย หรือหากได้รับในปริมาณมากก็อาจทำให้เสียชีวิตได้ ดังนั้นผู้ปฏิบัติงานที่เกี่ยวข้องกับรังสีจึงจะต้องมีอุปกรณ์ที่ช่วยป้องกันอันตรายจากรังสี และมีการกำหนดระยะเวลาในการทำงานเพื่อไม่ให้สัมผัสกับรังสีเป็นเวลานานเกินไป
ประโยชน์จากการใช้ธาตุกัมมันตรังสี
1. ด้านธรณีวิทยา การใช้คาร์บอน- 14 (C-14) คำนวณหาอายุของวัตถุโบราณ ด้านการแพทย์ ใช้ไอโอดีน- 131 (I-131) ในการติดตามเพื่อศึกษาความผิดปกติของต่อมไธรอยด์ โคบอลต์- 60 (Co-60) และเรเดียม- 226 (Ra-226) ใช้รักษาโรคมะเร็ง ด้านเกษตรกรรม ใช้ฟอสฟอรัส 32 (P-32) ศึกษาความต้องการปุ๋ยของพืช ปรับปรุง เมล็ดพันธุ์ที่ต้องการและใช้โพแทสเซียม- 32 (K–32) ในการหาอัตราการดูดซึมของต้นไม้ 4. ด้านอุตสาหกรรม ใช้ธาตุกัมมันตรังสีตรวจหารอยตำหนิ เช่น รอยร้าวของโลหะหรือท่อขนส่งของเหลว ใช้ธาตุกัมมันตรังสีในการ ตรวจสอบและควบคุมความหนาของวัตถุ ใช้รังสีฉายบนอัญมณีเพื่อให้มีสีสันสวยงาม
5. ด้านการถนอมอาหาร ใช้รังสีแกมมาของธาตุโคบอลต์- 60 (Co–60) ปริมาณที่พอเหมาะใช้ทำลายแบคทีเรียในอาหาร จึงช่วยให้เก็บรักษาอาหารไว้ได้นานขึ้น 6. ด้านพลังงาน มีการใช้พลังงานความร้อนที่ได้จากปฏิกิริยานิวเคลียร์ในเตาปฏิกรณ์ปรมาณูของยูเรีเนียม- 238 (U-238) ต้มน้ำให้กลายเป็นไอ แล้วผ่านไอน้ำไปหมุนกังหัน เพื่อผลิตกระแสไฟฟ้า

 อะตอมมีลักษณะทรงกลม และเป็นอนุภาคที่มีขนาดเล็กที่สุด ซึ่งแบ่งแยกไม่ได้ และไม่สามารถสร้างขึ้นใหม่หรือทำให้สูญหายไปได้จอห์น ดอลตัน นักวิทยาศาสตร์ชาวอังกฤษ เป็นนักเคมีคนแรกที่เสนอแนวคิดเกี่ยวกับอะตอม ซึ่งมีสาระสำคัญดังนี้
อะตอมมีลักษณะทรงกลม และเป็นอนุภาคที่มีขนาดเล็กที่สุด ซึ่งแบ่งแยกไม่ได้ และไม่สามารถสร้างขึ้นใหม่หรือทำให้สูญหายไปได้จอห์น ดอลตัน นักวิทยาศาสตร์ชาวอังกฤษ เป็นนักเคมีคนแรกที่เสนอแนวคิดเกี่ยวกับอะตอม ซึ่งมีสาระสำคัญดังนี้ ธาตุประกอบด้วยอนุภาคเล็ก ๆ หลายอนุภาค อนุภาคเหล่านี้เรียกว่า อะตอม ซึ่งแบ่งแยกและทำให้สูญหายหรือสร้างขึ้นใหม่ไม่ได้
ธาตุประกอบด้วยอนุภาคเล็ก ๆ หลายอนุภาค อนุภาคเหล่านี้เรียกว่า อะตอม ซึ่งแบ่งแยกและทำให้สูญหายหรือสร้างขึ้นใหม่ไม่ได้ อะตอมของธาตุชนิดเดียวกันย่อมมีสมบัติเหมือนกัน มีมวลเท่าๆ กัน แต่มีสมบัติแตกต่างจากอะตอมของธาตุอื่น ๆ
อะตอมของธาตุชนิดเดียวกันย่อมมีสมบัติเหมือนกัน มีมวลเท่าๆ กัน แต่มีสมบัติแตกต่างจากอะตอมของธาตุอื่น ๆ สารประกอบเกิดจากอะตอมของธาตุมากกว่า 1 ชนิด ทำปฏิกิริยากันในอัตราส่วนที่เป็นเลขลงตัวอย่างง่าย2) แบบจำลองอะตอมของทอมสัน
สารประกอบเกิดจากอะตอมของธาตุมากกว่า 1 ชนิด ทำปฏิกิริยากันในอัตราส่วนที่เป็นเลขลงตัวอย่างง่าย2) แบบจำลองอะตอมของทอมสัน อะตอม ประกอบด้วย อนุภาคโปรตอนและอิเล็กตรอนกระจายอยู่ทั่วไปอย่างสม่ำเสมอ อะตอมในสภาพที่เป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับประจุลบ เซอร์โจเซฟ จอห์น ทอมสัน นักวิทยาศาสตร์ชาวอังกฤษ ได้ทำการศึกษาและทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซโดยใช้หลอดรังสีแคโทด ได้ผลสรุปด้งนี้ค่าอัตราส่วนประจุต่อมวลของอนุภาคลบหรืออิเล็กตรอน (e
อะตอม ประกอบด้วย อนุภาคโปรตอนและอิเล็กตรอนกระจายอยู่ทั่วไปอย่างสม่ำเสมอ อะตอมในสภาพที่เป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับประจุลบ เซอร์โจเซฟ จอห์น ทอมสัน นักวิทยาศาสตร์ชาวอังกฤษ ได้ทำการศึกษาและทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซโดยใช้หลอดรังสีแคโทด ได้ผลสรุปด้งนี้ค่าอัตราส่วนประจุต่อมวลของอนุภาคลบหรืออิเล็กตรอน (e ) มีค่าเท่ากับ
) มีค่าเท่ากับ  คูลอมบ์ต่อกรัม ซึ่งมีค่าคงที่เสมอไม่ขึ้นอยู่กับชนิดของก๊าซและโลหะที่ใช้ทำแคโทดสรุปแบบจำลองอะตอมของทอมสันอะตอมมีลักษณะเป็นทรงกลุม มีอนุภาคที่มีประจุบวก เรียกว่า โปรตอน อนุภาคที่มีประจุลบ เรียกว่า อิเล็กตรอน และจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอนกระจายอยู่ทั่วไปในทรงกลม
คูลอมบ์ต่อกรัม ซึ่งมีค่าคงที่เสมอไม่ขึ้นอยู่กับชนิดของก๊าซและโลหะที่ใช้ทำแคโทดสรุปแบบจำลองอะตอมของทอมสันอะตอมมีลักษณะเป็นทรงกลุม มีอนุภาคที่มีประจุบวก เรียกว่า โปรตอน อนุภาคที่มีประจุลบ เรียกว่า อิเล็กตรอน และจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอนกระจายอยู่ทั่วไปในทรงกลม
 รอเบิร์ต แอนดูรส์ มิลลิแกน ได้ทำการทดลองต่อจากทอมสัน เพื่อหาประจุที่มีอยู่ในอิเล็กตรอนแต่ละตัว
รอเบิร์ต แอนดูรส์ มิลลิแกน ได้ทำการทดลองต่อจากทอมสัน เพื่อหาประจุที่มีอยู่ในอิเล็กตรอนแต่ละตัว 
 แต่ละตัว มีประจุเท่ากับ
แต่ละตัว มีประจุเท่ากับ  คูลอมบ์
คูลอมบ์ แต่ละตัว มีมวลเท่ากับ
แต่ละตัว มีมวลเท่ากับ  คูลอมบ์
คูลอมบ์ ออยแกน โกลด์สไตน์ นักวิทยาศาสตร์ชาวเยอรมัน ได้ทำการทดลองโดยใช้หลอดรังสีแคโทด พบว่า อนุภาคบวก มีค่าอัตราส่วนประจุต่อมวลไม่คงที่ ขึ้นอยู่กับชนิดของก๊าซ และอนุภาคบวกที่เกิดจากไฮโดรเจน เรียกว่า โปรตอน์3) แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
ออยแกน โกลด์สไตน์ นักวิทยาศาสตร์ชาวเยอรมัน ได้ทำการทดลองโดยใช้หลอดรังสีแคโทด พบว่า อนุภาคบวก มีค่าอัตราส่วนประจุต่อมวลไม่คงที่ ขึ้นอยู่กับชนิดของก๊าซ และอนุภาคบวกที่เกิดจากไฮโดรเจน เรียกว่า โปรตอน์3) แบบจำลองอะตอมของรัทเทอร์ฟอร์ด  อะตอม ประกอบด้วย นิวเคลียสที่มีโปรตอนรวมอยู่ตรงกลาง มีขนาดเล็ก และมีมวลมาก และมีอิเล็กตรอนซึ่งมีมวลน้อยวิ่งอยู่รอบ ๆ นิวเคลียส ลอร์อเออร์เนสต์ รัทเทอร์ฟอร์ด นักวิทยาศาสตร์ชาวอังกฤษ และฮันส์ ไกเกอร์ นักวิทยาศาสตร์ชาวเยอรมัน ได้ทำการทดลองยิงอนุภาคแอลฟา (
อะตอม ประกอบด้วย นิวเคลียสที่มีโปรตอนรวมอยู่ตรงกลาง มีขนาดเล็ก และมีมวลมาก และมีอิเล็กตรอนซึ่งมีมวลน้อยวิ่งอยู่รอบ ๆ นิวเคลียส ลอร์อเออร์เนสต์ รัทเทอร์ฟอร์ด นักวิทยาศาสตร์ชาวอังกฤษ และฮันส์ ไกเกอร์ นักวิทยาศาสตร์ชาวเยอรมัน ได้ทำการทดลองยิงอนุภาคแอลฟา ( )ไปยังแผ่นทองคำบาง ๆ เรียกการทดลองนี้ว่าการทดลองการกระเจิงรังสีอัลฟาของรัทเทอร์ฟอร์ด
)ไปยังแผ่นทองคำบาง ๆ เรียกการทดลองนี้ว่าการทดลองการกระเจิงรังสีอัลฟาของรัทเทอร์ฟอร์ด )ไปยังอะตอมของธาตุต่าง ๆ และได้สรุปว่า ในนิวเคลียสของอะตอมมีอนุภาคที่เป็นกลางทางไฟฟ้า เรียกว่า นิวตรอน ดังนั้นแบบจำลองอะตอม จึงมีลักษณะดังรูป
)ไปยังอะตอมของธาตุต่าง ๆ และได้สรุปว่า ในนิวเคลียสของอะตอมมีอนุภาคที่เป็นกลางทางไฟฟ้า เรียกว่า นิวตรอน ดังนั้นแบบจำลองอะตอม จึงมีลักษณะดังรูป  4) แบบจำลองอะตอมของนีลส์ โบร์
4) แบบจำลองอะตอมของนีลส์ โบร์
 นีลส์ โบร์ นักวิทยาศาสตร์ชาวเดนมาร์ก ได้ทำการศึกษาการเกิดสเปกตรัมของก๊าซไฮโดรเจน และได้สร้างแบบจำลองอะตอมเพื่อใช้อธิบายลักษณะการเคลื่อนที่ของอิเล็กตรอนรอบ ๆ นิวเคลียสเป็นวงคล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ แต่ละวงจะมีระดับพลังงานเฉพาะตัว และเรียกระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้นิวเคลียสที่สุด ซึ่งมีระดับพลังงานต่ำที่สุด เรียกว่า ระดับพลังงาน K และเรียกระดับพลังงานถัดออกมาว่า ระดับพลังงาน L,M,N,… ตามลำดับ5) แบบจำลองอะตอมของกลุ่มหมอก
นีลส์ โบร์ นักวิทยาศาสตร์ชาวเดนมาร์ก ได้ทำการศึกษาการเกิดสเปกตรัมของก๊าซไฮโดรเจน และได้สร้างแบบจำลองอะตอมเพื่อใช้อธิบายลักษณะการเคลื่อนที่ของอิเล็กตรอนรอบ ๆ นิวเคลียสเป็นวงคล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ แต่ละวงจะมีระดับพลังงานเฉพาะตัว และเรียกระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้นิวเคลียสที่สุด ซึ่งมีระดับพลังงานต่ำที่สุด เรียกว่า ระดับพลังงาน K และเรียกระดับพลังงานถัดออกมาว่า ระดับพลังงาน L,M,N,… ตามลำดับ5) แบบจำลองอะตอมของกลุ่มหมอก อะตอมจะประกอบด้วย กลุ่มหมอกของอิเล็กตรอนรอบ ๆ นิวเคลียส โดยมีทิศทางไม่แน่นอน โอกาสที่จะพบอิเล็กตรอนบริเวณใกล้นิวเคลียสมีมากกว่าบริเวณที่อยู่ห่างจากนิวเคลียส เนื่องจากแบบจำลองอะตอมของโบร์ใช้อธิบายได้ดีเฉพาะธาตุไฮโรเจนซึ่งมีอิเล็กตรอนเพียงตัวเดียว ดังนั้นถ้าธาตุมีหลายอิเล็กตรอน ทฤษฏีของโบร์ไม่สามารถอธิบายได้ นักวิทยาศาสตร์จึงค้นคว้า ทดลองจนเกิดเป็นแบบจำลองอะตอมแบบกลุ่มหมอก ซึ่งมีลักษณะดังนี้
อะตอมจะประกอบด้วย กลุ่มหมอกของอิเล็กตรอนรอบ ๆ นิวเคลียส โดยมีทิศทางไม่แน่นอน โอกาสที่จะพบอิเล็กตรอนบริเวณใกล้นิวเคลียสมีมากกว่าบริเวณที่อยู่ห่างจากนิวเคลียส เนื่องจากแบบจำลองอะตอมของโบร์ใช้อธิบายได้ดีเฉพาะธาตุไฮโรเจนซึ่งมีอิเล็กตรอนเพียงตัวเดียว ดังนั้นถ้าธาตุมีหลายอิเล็กตรอน ทฤษฏีของโบร์ไม่สามารถอธิบายได้ นักวิทยาศาสตร์จึงค้นคว้า ทดลองจนเกิดเป็นแบบจำลองอะตอมแบบกลุ่มหมอก ซึ่งมีลักษณะดังนี้
 แต่ละตัว มีประจุเท่ากับ
แต่ละตัว มีประจุเท่ากับ  คูลอมบ์
คูลอมบ์ แต่ละตัว มีมวลเท่ากับ
แต่ละตัว มีมวลเท่ากับ  คูลอมบ์
คูลอมบ์























(10).jpg)

.jpg)
.jpg)
 ประกอบด้วย
ประกอบด้วย และ
และ ส่วน
ส่วน ประกอบด้วย
ประกอบด้วย และ
และ ทั้ง
ทั้ง และ
และ จัดเป็นไอออนเชิงซ้อนที่มีธาตุแทรนซิชันเป็นอะตอมกลางและยึดเหนี่ยวกับอะตอมหรือไอออนอื่นๆ ที่มาล้อมรอบด้วยพันธะโคออร์ดิเนตโคเวเลนต์ เขียนแสดงได้ดังนี้
จัดเป็นไอออนเชิงซ้อนที่มีธาตุแทรนซิชันเป็นอะตอมกลางและยึดเหนี่ยวกับอะตอมหรือไอออนอื่นๆ ที่มาล้อมรอบด้วยพันธะโคออร์ดิเนตโคเวเลนต์ เขียนแสดงได้ดังนี้(10).jpg)
 ประกอบด้วย
ประกอบด้วย และ
และ ส่วน
ส่วน ประกอบด้วย
ประกอบด้วย และ
และ ทั้ง
ทั้ง และ
และ จัดเป็นไอออนเชิงซ้อนที่มีธาตุแทรนซิชันเป็นอะตอมกลางและยึดเหนี่ยวกับอะตอมหรือไอออนอื่นๆ ที่มาล้อมรอบด้วยพันธะโคออร์ดิเนตโคเวเลนต์ เขียนแสดงได้ดังนี้
จัดเป็นไอออนเชิงซ้อนที่มีธาตุแทรนซิชันเป็นอะตอมกลางและยึดเหนี่ยวกับอะตอมหรือไอออนอื่นๆ ที่มาล้อมรอบด้วยพันธะโคออร์ดิเนตโคเวเลนต์ เขียนแสดงได้ดังนี้ ซึ่งแตกต่างจากสารตั้งต้นที่มีสีฟ้า การเปลี่ยนแปลงที่เกิดขึ้นเขียนสมการแสดงได้ดังนี้
ซึ่งแตกต่างจากสารตั้งต้นที่มีสีฟ้า การเปลี่ยนแปลงที่เกิดขึ้นเขียนสมการแสดงได้ดังนี้(9).jpg)
 ดังสมการ
ดังสมการ(9).jpg)


ไม่มีความคิดเห็น:
แสดงความคิดเห็น